На 5 јули, Novo Nordisk започна фаза III клиничко испитување на инјекцијата CagriSema во Кина, чија цел е да се спореди безбедноста и ефикасноста на инјекцијата CagriSema со семеглутид кај дебели и пациенти со прекумерна тежина во Кина.
Инјекцијата CagriSema е комбинирана терапија со долго дејство која е во развој од Novo Nordisk, главни компоненти се GLP-1 (пептид-1 сличен на глукагон) рецептор агонист смеглутид и долгодејствувачки аналог на амилин кагрилинтид.Инјекцијата CagriSema може да се администрира субкутано еднаш неделно.
Примарната цел беше да се спореди CagriSema (2,4 mg/2,4 mg) со семеглутид или плацебо еднаш неделно субкутано.Novo Nordisk ги објави резултатите од испитувањето на CagriSema за третман на дијабетес стадиум 2, кое докажа дека хипогликемичниот ефект на CagriSema е подобар од оној на семеглутидот, а скоро 90% од испитаниците ја постигнале целта за HbA1c.
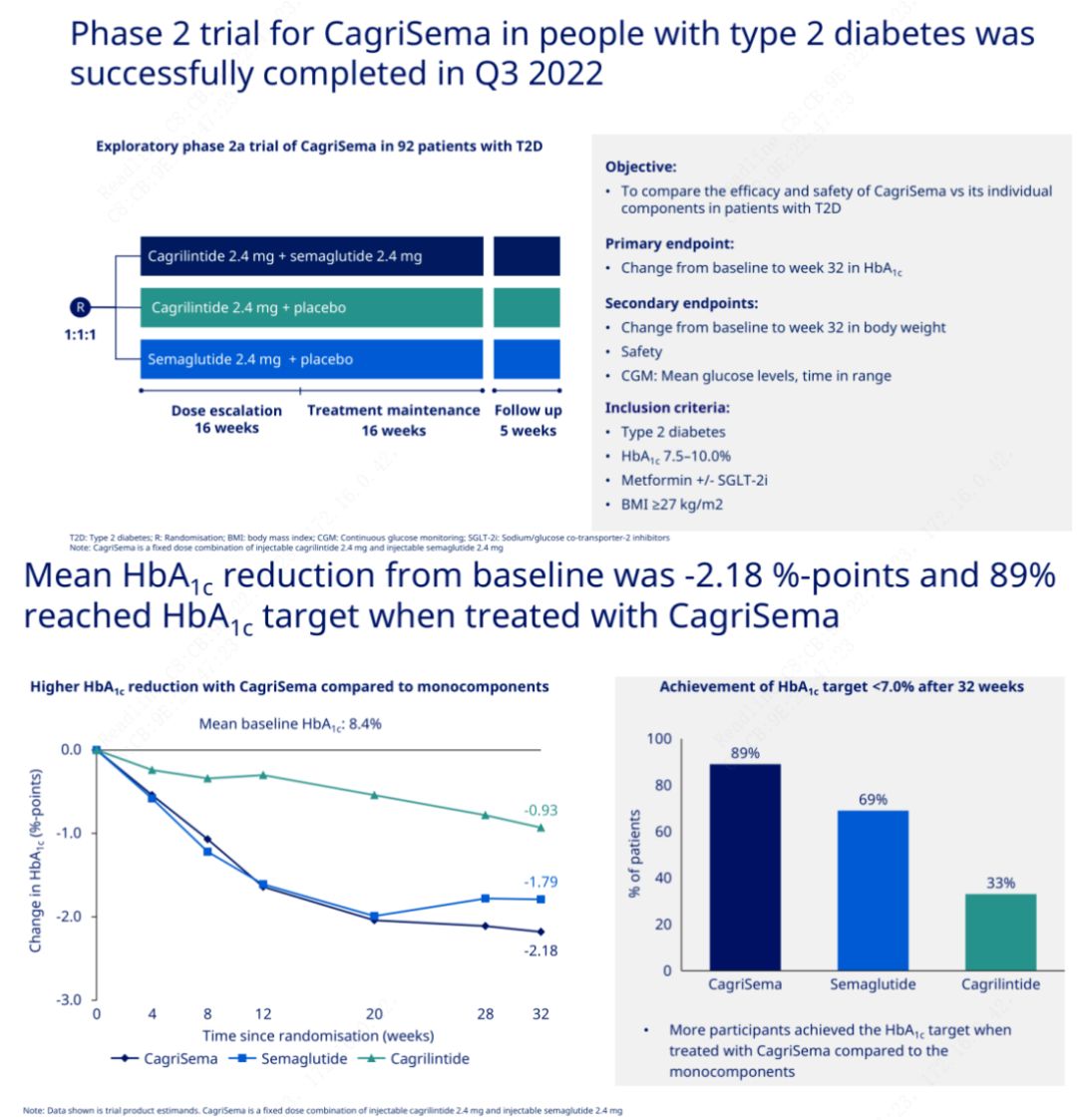
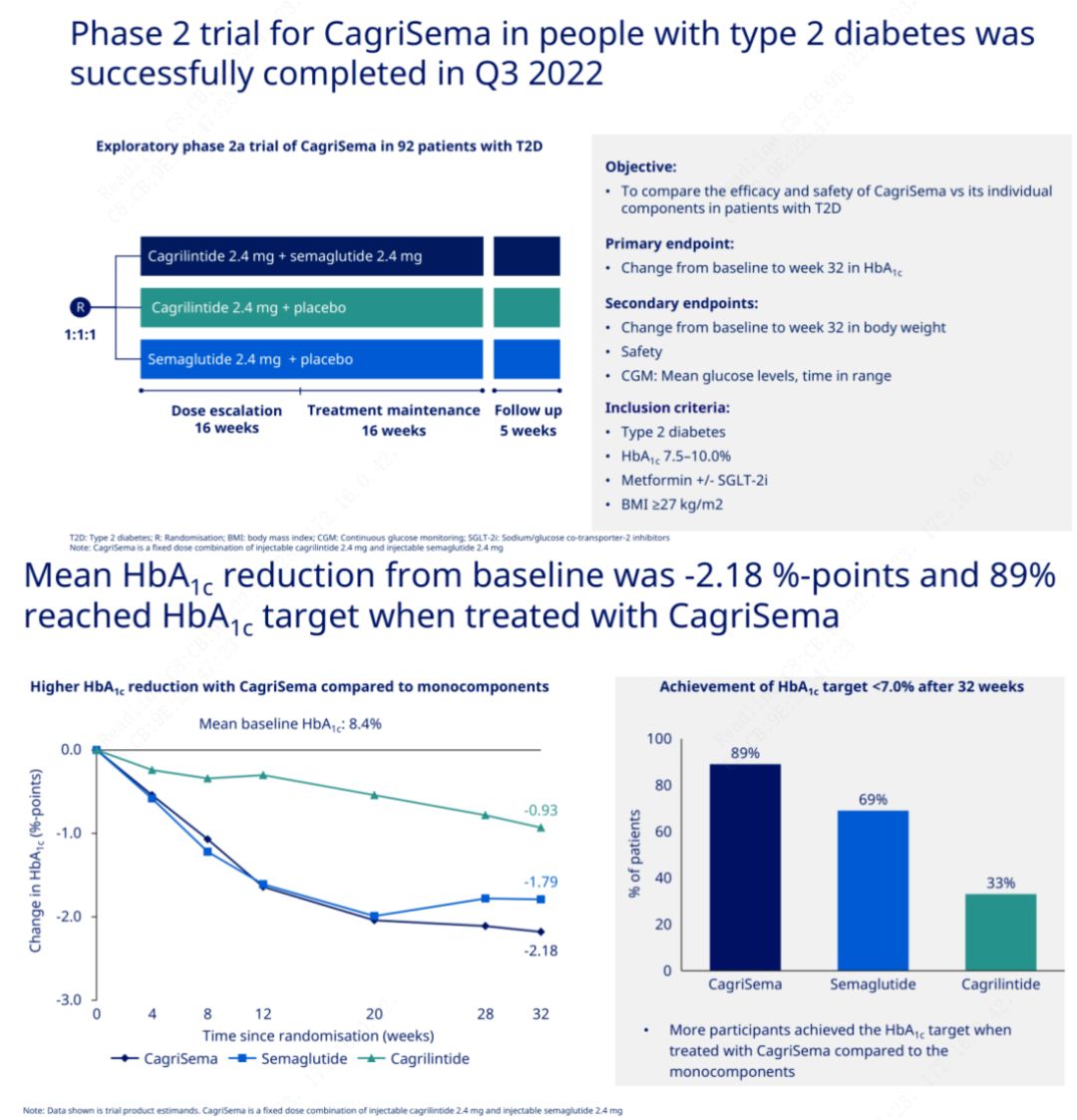
Податоците покажаа дека покрај значајниот хипогликемичен ефект, во однос на губење на тежината, инјекцијата CagriSema значително ги надминуваше семеглутидот (5,1%) и кагрилинтидот (8,1%) со губење на тежината од 15,6%.
Иновативниот лек Тирзепатид е првиот одобрен неделен агонист на рецепторот GIP/GLP-1 во светот.Ги комбинира ефектите на два инкретина во една молекула која се инјектира еднаш неделно и е нова класа на третмани за дијабетес тип 2.Тирзепатид беше одобрен од американската Администрација за храна и лекови (ФДА) во мај 2022 година за подобрување на гликемиската контрола (на диетална основа и вежбање) кај возрасни со дијабетес тип 2 и моментално е одобрен во Европската Унија, Јапонија и други земји.
На 5 јули, Ели Лили објави фаза III студија SURPASS-CN-MONO за регистрација на клиничко испитување на лекови и платформа за откривање информации за третман на пациенти со дијабетес тип 2.SURPASS-CN-MONO е рандомизирана, двојно слепа, плацебо-контролирана фаза III студија дизајнирана да ја процени ефикасноста и безбедноста на монотерапијата со тирзепатид во споредба со плацебо кај луѓе со дијабетес тип 2.Студијата планираше да опфати 200 пациенти со дијабетес тип 2 кои не користеле антидијабетични лекови во 90 дена пред посетата 1 (освен во одредени клинички ситуации, како што се акутна болест, хоспитализација или елективна операција, краткорочни (≤14 денови) употреба на инсулин).
Дијабетесот тип 2 се очекува да биде одобрен оваа година
Минатиот месец, резултатите од студијата SURPASS-AP-Combo беа објавени на 25 мај во блокбастерското списание Nature Medicine.Резултатите покажаа дека во споредба со инсулин гларгин, Тирзепатид покажал подобар HbA1c и намалување на тежината кај популацијата на пациенти со дијабетес тип 2 во азиско-пацифичкиот регион (главно Кина): намалување на HbA1c до 2,49% и намалување на тежината до 7,2 кг. (9,4%) на 40 недели од третманот, значително подобрување на липидите во крвта и крвниот притисок и севкупната безбедност и подносливост беа добри.
Клиничкото испитување од фаза 3 на SURPASS-AP-Combo е првата студија на Тирзепатид спроведена главно кај кинески пациенти со дијабетес тип 2, предводена од професорот Џи Линонг од Народната болница на Универзитетот во Пекинг.SURPASS-AP-Combo е конзистентен со резултатите од глобалната серија истражувања SURPASS, што дополнително докажува дека патофизиологијата на дијабетесот кај кинеските пациенти е конзистентна со онаа на глобалните пациенти, што е основа за истовремено истражување и развој на нови лекови во Кина и во светот, а исто така обезбедува цврсти докази за поддршка за давање можност на кинеските пациенти да ги користат најновите лекови за третман на дијабетес и нивна клиничка примена во Кина што е можно поскоро.
Време на објавување: 18-ти септември 2023 година

